Проблема усиления заболеваемости ОРВИ, включая инфекцию COVID-19 в период сезонных поллинозов является весьма актуальной для мирового здравоохранения и фармацевтики. Известно, что инфекционные и неинфекционные антигены могут способствовать дополнительной сенсибилизации организма, поскольку аллергию могут вызывать самые различные агенты: пыльца и споры растений, химические вещества, вирусы, бактерии и их токсины, микромицеты (плесневые и дрожжевые грибы), чешуйки кожи домашних животных, пыль, микроскопические клещи. Полисенсибилизация имеет под собой множество этиологических факторов. В ряде случаев, инфекция, особенно вирусная, может быть единственной причиной развития аллергического заболевания, выступая в качестве «суперантигена». Как пример – развитие аллергического ринита или бронхиальной астмы у ребенка после перенесенных ОРВИ, основным этиологическим агентом которых являлись риновирусы и респираторно-синцитиальные вирусы. Согласно литературных данных, отмечена корреляция между сезонным подъемом заболеваемости ОРВИ и частотой госпитализаций в связи с обострением бронхиальной астмы. Также, выявлена связь между летальными обострениями астмы и респираторной вирусной инфекцией [1].
Компилированные данные исследований, проведенных в рамках международных протоколов ISAAC (International Study of Asthma and Allergies in Childhood) и GA2LEN (Global Allergy and Asthma European Network) показали, что уровень заболеваемости бронхиальной астмой в возрастной группе 6 – 7 лет составил от 11,1% — 11,6%, в возрасте от 13-14 лет — 13,2% — 13,7% в возрастной категории 15-18 лет распространённость бронхиальной астмы составила 19,9% и 7,2% случаев соответственно. В США на долю бронхиальной астмы у детей приходится 8,4% от общего количества зарегистрированных случаев – 24,6 млн.человек, дети в возрасте от 0-4 лет составили 4,7%, от 5 до 14 лет – 9,8% [2,3].
По данным О.В.Зайцевой (2007), в Российской Федерации до 10% от детской популяции страдают бронхиальной астмой, в том числе и в тяжелых формах [4].
Согласно общепринятым воззрениям, на фоне аллергического фона создаются идеальные условия для возникновения инфекционного процесса и присоединения вторичной инфекции, поскольку аллергическая преморбидность порождает склонность к длительной персистенции инфекционного агента. В качестве примера можно привести поллиноз, который при отсутствии адекватной терапии может привести к гнойному гаймориту [1].
Эпидемиологические и иммунопатофизиологические исследования показывают, что самой распространенной причиной обострений аллергической патологии, выраженной в клинических проявлениях бронхиальной астмы, в 80–85% случаев у детей и 75% у взрослых являются острые респираторные вирусные инфекции [5,6].
В 2008 г. в США были опубликованы результаты проспективного наблюдения за 259 детьми в возрасте 0–6 лет жизни (Childhood Origins of Asthma (COAST) . Графическая компиляция полученных данных представлена на рис.1.
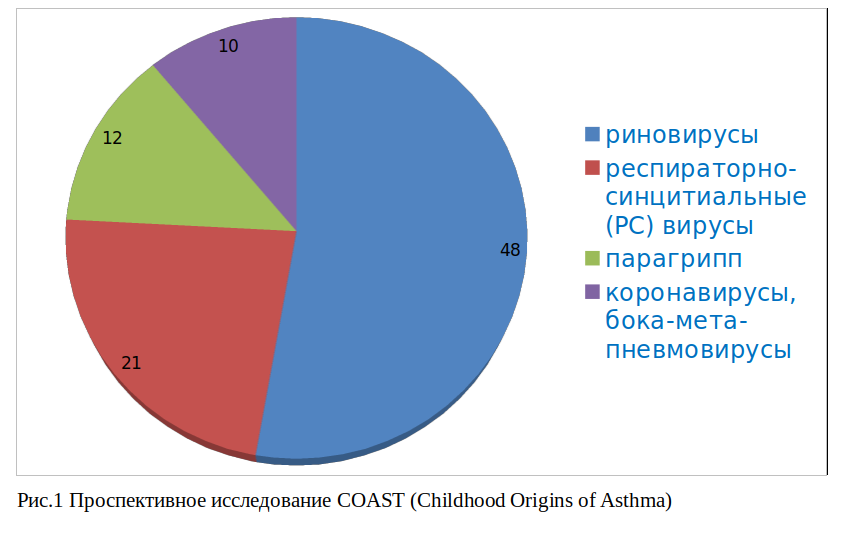
Согласно полученным данным, у 90% детей со свистящим дыханием в возрасте до 3 лет жизни были обнаружены вирусы (чаще всего антигены риновирусов — в 48% случаев, респираторно-синцитиальные вирусы были выявлены у 21% обследованных, вирус парагриппа у 12% и в 10% у больных выявлены иные виды вирусов – коноравирусы, бока-мета-пневмовирусы и др. Риск развития бронхиальной астмы или хронической обстурктивной болезни легких (ХОБЛ) повышался, если эпизоды бронхообструкций сочетались с сенсибилизацией к аэроаллергенам. Интересен тот факт, что 90% детей (26 из 30 обследованных), у которых до трех лет жизни отмечались бронхообструкции, вызванные риновирусами, уже к 6 годам имели четкий клинический диагноз бронхиальной астмы [7,8].
По сообщениям авторов, среди детей школьного возраста вирусная инфекция, составляет до 85% обострений бронхиальной астмы и вирусы чаще изолируются от симптоматических пациентов, чем от бессимптомных пациентов. При этом, по данным Satia I.et al.(2020), хотя риновирус и был идентифицирован как основной этиологический триггер развития и обострений бронхиальной астмы у детей и взрослых, достоверных данных о роли нового коронавируса SARS-CoV-2 в развитии бронхообструктивного синдрома и астмы на сегодняшний день недостаточно [9,10].
Cледует отметить, что в предыдущих вспышках ОРВИ пациенты с бронхиальной астмой, в частности дети, оказались менее восприимчивыми к коронавирусу – авторы в своей работе 2020 года показали низкую частоту обострений астмы и хороший прогноз при последующем наблюдении. Напротив, по мнению Ludvigsson J.F. (2020), во время эпидемий гриппа астма ассоциировалась с более тяжелым течением заболевания, в том числе с необходимостью проведения ИВЛ, причем не только у взрослых, но и у детей [ 11,12].
В период повышенной аллергической реактивности, когда начинается выделение пыльцы растений, а некоторые животные претерпевают линьку, выделяя во внешнюю среду белковые продукты, обладающие высокой степенью сенсибилизации, сопутствующие вирусные инфекции могут вызывать как активацию, так и угнетение иммунных функций. Существует корреляционная зависимость между атопическим фенотипом и снижением противовирусного иммунитета: так, у атопиков нарушен синтез интерферонов I типа – α и β [13].
А фермент эндорибонуклеаза коронавируса SARS-CoV-2, вызывающего инфекцию COVID-19, подавляют раннюю активацию интерферона не только в эпителиальных клетках, но и в макрофагах. Установлено, что альвеолярные макрофаги легочной ткани, которые первыми должны бросаться на любой антиген и патоген в легких, будь то вирус, бактерия или химическая молекула – совершенно не продуцируют интерфероны в ответ на внедрение вируса SARS-CoV-2, хотя известно, что именно эти макрофаги активно производят интерфероны при любых легочных вирусных инфекциях. Кроме того, эти макрофаги не обеспечивают экспрессию интерферон-стимулированных генов (ISG), а это означает, что на начальной стадии инфекции иммунная система не активируется должным образом и вирус реплицируется в организме еще до повреждения легочной ткани [14-17].
Итак, в процессе вирусного филогенеза новый коронавирус научился использовать многочисленные механизмы подавления интерфероногенеза и уклонения от иммунного ответа. В частности, в ходе экспериментов на клеточных культурах ученые обнаружили, что белок ORF8 вируса SARS-CoV-2 непосредственно взаимодействует с белками главного комплекса гистосовместимости MHC-I и уменьшает их количество на поверхности клеток различных типов. В клетках, экспрессирующих белок ORF8 вируса SARS-CoV-2, молекулы MHC-I избирательно направляются не на поверхность клетки для презентации антигена, а в лизосомы, где и деградируют, как при аутофагии. В результате цитотоксические T-лимфоциты (или NK-клетки – «нормальные киллеры») не могут эффективно распознавать и уничтожать инфицированные вирусом клетки [18-27].
Респираторная вирусная инфекция выступает также в качестве самостоятельного мощного аллергена у оиц, подверженных аллергизации. У больных-атопиков наблюдается повышение уровня IgE и отмечается усиление различных фаз иммунно-аллергического товета как немедленного, так и замедленного типа. Вирусная инфекция у больных аллергическими заболеваниями вызывает эозинофильное воспаление слизистой оболочки бронхов, сохраняющееся даже после клинического выздоровления. Способность активировать эозинофилы, а также увеличивать уровень лейкотриена С4 в назальном секрете больных астмой обнаружена у риновируса и респираторно-синцитиальной инфекции [1].
Пандемия инфекции COVID-19 внесла свои коррективы в практику поведения аллергиков и атопиков в высокий аллергический сезон. По данным отечественного исследователя Луневой Е.Н. (2020), пациентам, страдающим сезонными аллергическими заболеваниями, в период цветения растений, в весенние и летние месяцы, необходимо минимизировать пребывание в парковых зонах, на дачных участках и просто на улице. Следует не открывать окна в сухие ветреные дни, поскольку при такой погоде содержание пыльцы в воздухе особенно высоко. После дождя, напротив, пыльцы становится гораздо меньше, а значит, это лучшее время для проветривания помещений и прогулок. Выстиранную одежду желательно сушить в помещении, а не на улице, где на нее может осесть пыльца цветущих растений, которая вызовет аллергию сразу же, как только вы наденете одежду. Необходимо предупреждать попадание пыльцы растений в жилые помещения: закрывать форточки и окна сеткой, менять одежду при возвращении с улицы и принимать душ. Дополнительно можно использовать очистители воздуха. Кроме того, важным является исключение из рациона пищевых продуктов и фитопрепаратов, которые обладают перекрестными аллергенными свойствами с пыльцой растений. В условиях карантина концентрация домашних аллергенов, возрастает. Поэтому пациентам, которые страдают бытовой, эпидермальной и грибковой аллергией надо чаще делать дома влажную уборку, заменить шерстяные одеяла и пуховые подушки на синтетические. Крайне важно поддерживать оптимальный уровень влажности помещения в объеме 40–50% [28].
Молекулярно-биологические особенности вируса SARS-CoV-2 в части блокировки синтеза интерферона и возникающий при этом интерфероновый дефицит являются свидетельством необходимости создания высоких концентраций экзогенного интерферона в периферической крови пациентов для обеспечения адекватной противовирусной защиты в период повышенного преморбидного аллергического фона. Применение препаратов интерферона при лечении инфекционно-аллергического фенотипа бронхиальной астмы или ХОБЛ достаточно широко описаны в литературе. Так, отечественный исследователь Жаков Я.И. с соавт. (2020) успешно применял препарат рекомбинантного интерферона α2b. Авторы наблюдали снижение IgE в 1,6 раза в мокроте у детей, которое коррелировало с уменьшением эозинофилов, увеличение в 1,5 раза уровня IL-10, а 75% родителей высказали удовлетворение от применения препарата.
Согласно проведенным в США исследованиям, на сегодняшний день имеются неопровержимые доказательства влияния интерферонов на экспрессию генов, кодирующих синтез белков неполного, «инвалидного» рецептора АСЕ2, так наз. deltaACE2 (dACE2). Наличие на мембране эпителиальных клеток такого укороченного рецептора dACE2 препятствует соединению с ним S-белка коронавируса SARS-CoV-2, в связи с чем, заражение вирусом клетки не происходит. Данный факт является дополнительным обоснованием применения препаратов экзогенного интерферона для профилактики вирусных инфекций в период высокого аллергофона [31].
В этой связи, используя наш практический опыт и знания, мы бы рекомендовали в качестве лечебно-профилактического средства отечественный препарат рекомбинантного интерферона α2b с антиоксидантами – «ВИФЕРОН». Препарат может применяться у детей с первых дней жизни, беременных, пациентов различных возрастных групп. Выпускаемый более 20 лет на отечественном, сертифицированном по стандартам GMP фармпредприятии в 3-х лекарственных формах – гель, мазь и ректальные суппозитории, препарат зарекомендовал себя в качестве надежного противовирусного и иммуномодулирующего средства, нашедшего достойный отклик в сердцах клиницистов и пациентов.
Список литературы:
1. Царев С.В. Инфекция и аллергия: взаимосвязь и взаимовлияние // РМЖ. 2016. No 12. С. 800–803.
2. Pearce N., Aït-Khaled N., Beasley R., Mallol J., Keil U., Mitchell E. Worldwide trends in the prence of asthma symptoms: phase III of the International Study of Asthma and Allergies in Childhood (ISAAC).//Thorax [Internet]. 2007;62(9):758–66. Available from:
http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=2117323&tool=pmcentrez&re ndertype=abstract;
3. Бронхиальная астма. Клинические рекомендации Минздрава РФ, 2017;
4. Зайцева О.В. Бронхиальная астма у детей //РМЖ – 2007, №7, С.582
5.Message S., Laza-Stanca V., Mallia P. et al. Rhinovirus-induced lower respiratory illness is increased in asthma and related to virus load and Th1/2 cytokine and IL-10 production // Proc Nat Acad Scienю 2008; vol. 105: 13562–13567;
6. Carroll K.N., Wu P., Gebretsadik T. The severity — dependent relationship of infant bronchiolitis on the and morbidity of early chldhood asthma // J Allergy Clin Immunol. 2009, May; 123 (5): 1055–1061;
7. Von Linstow M., Holst K., Larsen K. et al. Acute respiratory symptoms and general illness during the first year of life: a population-based birth cohort study // Pediatr Pulmonol. 2008; 43: 584–593.
8. Мачарадзе Д.Ш. Вирусы и астма: больше вопросов, чем ответов // Лечащий врач – 2009, № 10, С.1-5
9.Papadopoulos N.G., Christodoulou I., Rohde G., Agache I., Almqvist C., Bruno A., et al. Viruses and bacteria in acute asthma exacerbations-a GA² LEN-DARE systematic review.// Allergy. 2011 Apr;66(4):458–68.
10.Satia I., Cusack R., Greene J.M., O’Byrne P.M., Killian K.J., Johnston N. Prence and contribution of respiratory viruses in the community to rates of emergency department visits and hospitalizations with respiratory tract infections, chronic obstructive pulmonary disease and asthma. PLoS One. 2020 Feb;15(2):e0228544.
11. Halpin D.M., Faner R., Sibila O., Badia J.R., Agusti A. Do chronic respiratory diseases or their treatment affect the risk of SARS-CoV-2 infection?// Lancet Respir Med. 2020 May;8(5):436–8.
12. Ludvigsson J.F. Systematic review of COVID-19 in children shows milder cases and a better prognosis than adults. //Acta Paediatr. 2020 Jun;109(6):1088–95.
13. Gehlhar K., Bilitewski C., Reinitz-Rademacher K. et al. Impaired virus-induced interferon-alpha2 release in adult asthmatic patients // Clin Exp Allergy. 2006. Vol. 36. Р. 331–337.
14. Deng X., Aaron Vol A., , Yafang Chen Y., Kristina Kesely R.R., Matthew Hackbart M., Robert C. Mettelman R.C., et al Coronavirus Interferon Antagonists Differentially Modulate the Host Response during Replication in Macrophages// https://www.biorxiv.org/content/10.1101/782409v1.full Posted September 25, 2019).
15.Chen C., Zhou Y., Wang D.W. SARS-CoV-2: a potential noveletiology of fulminant myocarditis.// Herz. 2020;10.1007/s00059-020-04909-z. doi:10.1007/s00059-020-04909-z
16. Chiodo F. et al. // Novel ACE2-independent carbohydrate-binding of SARS-CoV-2 spike protein to host lectins and lung microbiota. // BioRxiv, May 14, 2020; DOI: 10.1101/2020.05.13.092478 )
17. Dalskov L., et al. // SARS‐CoV‐2 evades immune detection in alveolar macrophages. // EMBO Reports (2020)e51252; DOI: 10.15252/embr.202051252
18. Смирнов В.С., Тотолян А.А. Врожденный иммунитет при коронавирусной инфекции. // Инфекция и иммунитет. 2020, Том 10, №2; https://doi.org/10.15789/2220-7619-III-1440;
19. Kikkert M. Innate Immune Evasion by Human Respiratory RNA Viruses. J Innate Immun. 2020;12(1):4-20. doi: 10.1159/000503030;
20. Abigail Vanderheiden, et al. // Type I and Type III IFN Restrict SARS-CoV-2 Infection of Human Airway Epithelial Cultures. // bioRxiv 2020.05.19.105437; DOI: 10.1101/2020.05.19.105437;
21. Yoriyuki Konno, et al. // SARS-CoV-2 ORF3b is a potent interferon antagonist whose activity is further increased by a naturally occurring elongation variant. //bioRxiv, May 12, 2020; DOI: 10.1101/2020.05.11.088179;
22. Melissa Saichi et al. // Single cell RNA sequencing of blood antigen-presenting cells in severe Covid-19 reveals multi-process defects in antiviral immunity // bioRxiv, 2020. DOI: 10.1101/2020.07.20.212837;
23. Ivashkiv L., Donlin L. Regulation of type I interferon responses. Nature reviews Immunology. 2014;14(1):36-49. doi: 10.1038/nri3581.
24. de Wit E , van Doremalen N , Falzarano D , Munster V. SARS and MERS: recent insights into emerging coronaviruses. Nat Rev Microbiol. 2016;14(8):523-34. doi: 10.1038/nrmicro.2016.81. ;
26. Ana Dominguez Andres, et al. // SARS-CoV-2 ORF9c Is a Membrane-Associated Protein that Suppresses Antiviral Responses in Cells. // bioRxiv 2020.08.18.256776; DOI: 10.1101/2020.08.18.256776;
27. Y. Zhang, et al. // The ORF8 Protein of SARS-CoV-2 Mediates Immune Evasion through Potently Downregulating MHC-I. // bioRxiv, 2020.05.24.111823
28.Лунёва Е.Н. Как вести себя аллергику в период пандемии коронавирусной инфекции? // Астма и аллергия,-2020, №1, С.19-20
30. Жаков Я.И., Минина Е.Е., Медведева Л.В. Сравнительная оценка воспалительных фенотипов бронхиальной астмы у детей при проведении профилактического курса препарата рекомбинантного интерферона альфа-2b. Вопросы практической педиатрии. 2020; 15(1): 87–94. DOI: 10.20953/1817-7646-2020-1-87-94
31. Olusegun O. Onabajo A. Prokunina-Olsson L.et al. Interferons and viruses induce a novel primate-specific isoform dACE2 and not the SARS-CoV-2 receptor ACE2 // bioRxiv, 2020, doi.org/10.1101/2020.07.19.210955 Now published in Nature Genetics doi: 10.1038/s41588-020-00731-9